بررسی چرخه سلولی در لنفوسیت های T فعال شده انسانی توسط آنتی بادی های مونوکلونال در شرایط In vitro با استفاده از تکنیک فلوسایتومتری
تکثیر لنفوسیت T برای ایجاد پاسخ ایمنی بسیار مهم است. تکثیر لنفوسیت T با سه نوع مولکول سطحی تنظیم می شود. مرحله اصلی شناسایی پپتید توسط گیرنده ی سلول T ( TCR یا T cell receptor) و با کمک محرک هایی همچون CD28 به وجود می آید. تکثیر لنفوسیت های T که با درگیری گیرنده های سلول T و گیرنده های کمکی تحریکی آغاز می شود موجب بیان و ترشح فاکتورهای رشد سلول T یعنی اینترلوکین 2 و گیرنده ی آن می شود. IL-2 با برهمکنش با گیرنده باعث فعال سازی چندین مسیر پیام دهی داخل سلولی و در نهایت ورود سلول به چرخه سلولی و گسترش کلنی سلول ها می شود. در شرایط In vivo با همکاری سایر مولکول های کمکی تحریکی و سایتوکاین ها، آنتی ژن ها ممکن است باعث حفظ تکثیر سلول های T فعال شده شوند. میزان و طول مدت درگیری TCR و CD28 هر دو برای ترک فاز G0 چرخه سلولی ضروری هستند. فعال سازی کامل سیگنال 1و 2 در لنفوسیت های T باعث فعال سازی مولکول هایی در داخل سلول مانند انتقال دهنده های سیگنال و فعال کننده های نسخه برداری و آبشارهای پروتئین کینازی فعال شده با مایتوژن می شوند. این مولکول ها نقش مهمی در سیگنال های مشتق از سایتوکاین، سنتز پروتئین و گسترش سلول های T از طریق عبور از فاز G به فاز S چرخه سلولی دارند. پیشرفت چرخه سلولی از طریق افزایش بیان در گروهی از پروتئین به نام سایکلین ها انجام می شود. این پروتئین ها وقتی به مقدار کافی در سلول وجود داشته باشند کینازهای وابسته به سایکلین ها (CDK یا Cyclin-dependnt Kinase ) را که برای عبور از فازG1 به S ضروری هستند. فعال می کنند.
هدف:
هدف استراژی های سرکوب سیستم ایمنی که در حال حاضر وجود دارد و در آینده خواهند آمد، جستجوی موکول های جدیدی در این مسیر سیگنالینگ برای فعال سازی سلول های T مورد نیاز هستند، است. تنها نسبت کمی از لنفوسیت های T به دست آمده از گردش خون یا ارگان های لنفوئیدی، در شرایط In vitro به طور خود به خود تقسیم می شوند، اما اکثریت آنها توانایی ورود به چرخه سلولی را وقتی به دست می آورند که در محیط کشت تحریک شوند.آنتی ژن های خاص به صورت محلول یا متصل به سطح سلول در شرایط In vitro لنفوسیت ها را تحریک می کنند. آنتی بادی ها بر ضد CD3 عناصر اصلی در بسیاری از پروتکل های تکثیری سلول های T هستند. Anti-CD3 از طریق جزیی از کمپلکس گیرنده ی سلول T یعنی CD3 پیام تکثیر قوی را ارسال می کند (سیگنال1)، ولی در نبود پیام های کمک تحریکی ( سیگنال 2) نتیجه تکثیر اغلب آپوپتوز در سلول های T است.
در سال های اخیر فلوسایتومتری روشی جدید، مفید و سریع برای تعیین مقدار نسبی DNA در نمونه های کلینیکی شده است. آنالیز چرخه سلولی توسط تعیین مقدار نسبی DNA یکی از کاربردهای فلوسایتومتری است و ترسیم هیستوگرام DNA یک تصویر ثابت از نسبت سلول ها در فازهای مختلف چرخه سلولی است. کیفیت هیستوگرام DNA از پهنای Width پیک DNA سلول ها در فاز G1 چرخه سلولی ارزیابی می شود که توسط ضریب ثابت تغییر CV سرتاسر پیک اندازگیری می شود. فلوسایتومتری علاوه بر تعیین محتوای نسبی DNA سلول، توزیع سلولی را در فازهای مختلف چرخه سلولی نشان می دهد. در یک جمعیت سلولی در حال تکثیر سه فاز مختلف تشخیص داده می شود:
G0/G1 که سلول های در حال تقسیم نیستند، S که فاز سنتز DNA است و نیز فاز G2/M. با توجه به اینکه فازهای G2 و M (میتوز) محتوای DNA یکسانی دارند، بر اساس تفاوت در محتوای DNA از هم قابل تشخیص نسیتند. یک ویژگی معمول آنالیز DNA برای چرخه سلولی یافتن سلول های دوتایی و تکی می باشند. با ترسیم نمودار نقطه ای Width (flw2) در برابر area (FL2A) می توان سلول های Doublet در فاز G1 را از سلول های تکی G2/M تشخیص داد (شکل1). چندین رنگ فلوروسنت وجود دارد که قابلیت اتصال به DNA را دارند. پروپیدیوم یداید (PI یا Propidium iodide) رنگ عمده ای است که کاربرد بسیار زیادی دارد. PI در بین زنجیرهای دو رشته ای اسیدنوکلئیک قرار می گیرد و توسط لیزر آرگون در طول موج 488 نانومتر تحریک می شود و نور فلوروسانس قرمز را از خود پراکنده می سازد و چون از ورود این رنگ توسط سلول های زنده به داخل جلوگیری می شود یک راه تشخیص سلول های زنده از مرده، استفاده از همین نوع رنگ است.
هدف از این مطالعه، بررسی چرخه سلولی لنفوسیت های T تحریک شده با انتی بادی مونوکلونال Anti-CD3 و Anti-CD28 در زمان انکوباسیون مختلف با استفاده از فلوسایتومتری بود. در این مطالعه از رنگ PI برای بررسی چرخه سلولی لنفوسیت های T تحریک شده با آنتی بادی های مونوکلونال Anti-CD3 و Anti-CD28 و زمان های انکوباسیون مختلف استفاده شد.
یافته ها:
سلول هاT تحریک شده پس از انکوباسیون با زمان های متفاوت 24،48،72 و96 ساعت در زیر میکروسکوپ از نطر عدم وجود آلودگی و همچنین میزان Viability سلول ها و با استفاده از رنگ تریپان بلو مورد بررسی قرار گرفت و سلول ها با viability بالاتر از 98 درصد برای ادامه مراحل مورد استفاده قرار گرفتند. با مشاهده ی میکروسکوپی در کشت های 24، 48 ساعته معلوم شد که میزان تکثیر در سلول ها بیش از حد کم بوده است و آنالیز چرخه سلولی سلول های تحریک شده با استفاده از نمودارهای هیستوگرام هم معلوم کرد که سلول های تحریک شده بعد از 24 و 48 ساعت همه در فاز G1 چرخه سلولی بودند ولی سلول ها بعد از 72،96 ساعت وارد فاز S و G2/M هم شده بودند (جدول 1 و شکل 2).
همانطور که اشاره شد یکی از ویژگی معمول آنالیز DNA برای چرخه سلولی پیدا کردن سلول های دوتایی و تکی می باشد. سلول های دوتایی وقتی بوجود می آیند که دو سلول با محتوای DNA فاز G1 به صورت یک سلول با محتوای DNA مشابه فاز G2/M توسط فلوسایتومتر ثبت شود. اگر نمونه دارای تعداد زیادی سلول های دوتایی باشد، میتواند تعداد نسبی سلول ها در فاز G2/M چرخه سلولی را افزایش دهد و جمعیت G2/M به اشتباه محاسبه شود. به منظور تصحیح این خطا، دستگاه فلوسایتومتری این توانایی را دارد که تا سلول های دوتایی را از تکی تفکیک کنند. نور فلوروسنت نشر شده از رنگ DNA (FL2) یک سیگنال الکترونیک تولید می کند که می تواند به صورت HIGH (FL2-H) برای شدت رنگ ثبت شود و همچنین به صورت FL2-A و FL2-W نمونه اندازگیری شود. با ترسیم نمودار نقطه ای FL2-W در برابر FL2-A می توان سلول های دوتایی در فاز G1 را از سلول های تکی G2/M تمایز داد. DNA سلول ها در فاز G2/M دو برابر DNA سلول ها در فاز G1 است، ولی قطر هسته ای تنها در حدود 25 درصد بیشتر است. بنابراین این ها یک پیک سیگنال بلندتر در مقایسه با سلول های چسبیده در G1 دارند، ولی پهنای باریکتری دارند.
این مطالعه می تواند در راه اندازی تست فلوسایتومتری جهت بررسی شرایط و زمان های انکوباسیون مناسب برای تحریک لنفوسیت های T با Anti-CD3 و Anti-CD28 برای ورود به چرخه سلولی و تکثیر این سلول ها در شرایط In vitro و بررسی فازهای مختلف چرخه سلولی مفید باشد. در این مطالعه مشخص شد که سلول های T تحریک شده با Anti-CD3 و Anti-CD28 پس از گذشت 24 و 48 ساعت، وارد چرخه سلولی نشدند و تکثیر را شروع نکردند و همه سلول ها در فاز G1 بودند، ولی 72 ساعت پس از فعال سازی تعدادی از سلول ها به تدریج در حال ورود به فازهای S و G2/M بودند و در 96 ساعت پس از فعال سازی به مقدار کافی تحریک و وارد چرخه سلولی شدند. بنابراین تکثیر سلول ها اتفاق افتاده بود. همچنین آپوپتوز به میزان زیادی در سلول دیده نشده، بنابراین بهترین زمان انکوباسیون برای تحریک و تکثیر لنفوسیت های T 96 ساعت در نظر گرفته شد.
از آن جا که سلول ها برای ورود به چرخه سلولی و تکثیر، به دریافت دو سیگنال نیاز دارند، پس از دریافت سیگنال های مورد نیاز، آبشار های انتقال پیام به کمک مولکول های واسطه دردرون سلول ها به راه می افتد که نتیجه آن تولید فاکتورهای رشد مورد نیاز برای چرخه سلولی و تکثیر سلول می باشد. برای فعال شدن کامل این مسیرها و مولکولهای سیگنال دهی زمان مناسب بسیار اهمیت دارد. در واقع طول مدت تحریک لنفوسیت T از طریق TCR و کمک محرک آن CD28 برای خارج شدن سلول از فاز G0 و ورود آن به فاز G1 چرخه سلولی بسیار حیاتی می باشد.
بنابراین، تکثیر بسیار کم لنفوسیت های T که 24 و 48 ساعت تحریک شده بودند به دلیل کافی نبودن زمان برای تکمیل فعال سازی آبشارهای سیگنال دهی بوده است، ولی در تحریک 72 ساعته ی لفنوسیت ها، زمان کافی برای فعال سازی مسیر سیگنال دهی و ورود به چرخه سلولی فراهم شده بود و سلول های چرخه سلولی را به طور کامل طی کردند و تکثیر شدند.
اگرچه مکانیسمی که توسط آن رشد سلولی و چرخه سلولی هماهنگ می شود تا حد زیادی ناشناخته مانده است، ولی پروتئین های پیام دهی اصلی که هم رشد و هم پیشرفت چرخه سلولی را در گونه های متخلف تنظیم میکنند شناخته شده اند. این پروتئین ها از طریق مولکولهای اجرایی که در مسیر پیام دهی قرار گرفته اند ترجمه mrna پروتئین های چرخه سلولی را تنظیم می کنند و باعث پیشرفت فاز G1 به S و تکثیر سلولی می شوند. به دست اوردن شرایط مناسب تحریک لنفوسیت های T در In vitro می تواند برای کاربردهای درمانی قابل بررسی باشد و مورد استفاده قرار گیرد و همچنین از نتایج به دست آمده برای بررسی اثر داروها بر چرخه سلولی لنفوسیت های T استفاده گردد.
برای اطلاعات بیشتر به سایت فرمند دانش ابزار مراجعه نمائید.
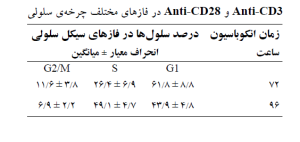
جدول 1 : درصد سلول های T تحریک شده با آنتی بادی های
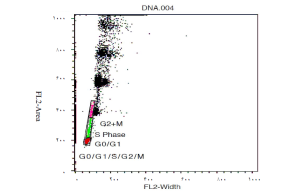
شکل 1: نمودار نقطه ای FL2A/FL2W برای محتوای DNA و تشخیص DOUBLET محدوده ای در اطراف جمعیت G0/G1/S/G2/M ایجاد شده است.
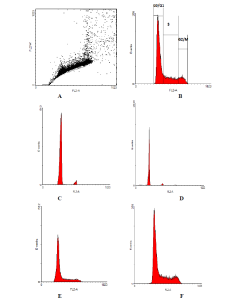
شکل 2: نمودار هیستوگرام چرخه سلولی لنفوسیت T فعال شدهی انسانی. شدت فلوروسنت PI توسط فلوسایتومتری اندازگیری شده است. هیستوگرام A نشان دهنده ی سلول های تکی جدا شده است که با ترسیم FL2-W در برابر FL2-A به دست آمده اند. هیستوگرام B نمایان گر یه الگوی تیپک فازهای G0/G1/S/G2/M چرخه سلولی در یک لنفوسیت T میباشد. هیستوگرام های C تا F الگوی چرخه سلولی لنفوسیت های T را به ترتیب 24،48،72 و 96 ساعت از فعال سازی نشان می دهد. هیستوگرام های C ,D تنها دارای پیک G1 هستند ولی E ,F دارای هر سه پیک G1/S/G2/M هستند.
دانلود کاتالوگ و منبع مقاله: 1951-9201-3-PB