نقش تشخیصی رنگ PSA
برای ارزیابی حساسیت و مشخصه رنگ ایمونوهیستوشیمی PSA در تشخیص سرطان پروستات، 12,824مورد سرطان پروستات و 2,845 تومور از منشاء دیگر با دو غلظت آنتی بادی مورد ارزیابی قرار گرفتند. دادههای دستههای مختلف سرطان پروستات و انواع تومورهایی که گاهی رنگ PSA را نشان میدهند در جدول-2 نشان داده شده است.در(1:800) ، به میزان 99/9 درصد از گلیسون کوچکتر یا مساوی 3+4 (Gleason ≤3+4) رنگ PSA قابل تشخیص است. این تعداد از سرطانهای با «PSA منفی» از طریق تمایززدایی سرطان افزایش یافت، اما حتی در مورد سرطانهای مقاوم به اختگی، میزان مثبت بودن همچنان بیش از80 درصد بود. با این حال، فقط در یک مورد از 13 مورد کارسینوم سلولهای کوچک نورواندوکرین پروستات، نمایه PSA آشکار شد. در تمام این سرطانهای پروستات، استفاده از غلظت آنتیبادی هشت برابری، میزان مثبت بودن را افزایش داد.
این افزایش فقط در سرطانهایی با گلیسون کوچکتر یا مساوی 3+4 (Gleason ≤3+4) نامحسوس بود، اما در سرطانهای تمایزنیافته، این افزایش چشمگیرتر بود. رنگ ایمونوهیستوشیمی PSA در تومورهای پروستات، کاملا مشخص نبود.با این حال، فقط در یک مورد سرطان خارج از پروستات، یعنی سرطان اندومتروئید تخمدان، رنگ PSA در (1:800) قابل تشخیص بود (شکل A5). در (1:100) مثبت بودن PSA در 8 مورد دیگر از سرطانهای قابل تفسیر خارج از پروستات (در مجموع 9 مورد از 2,845یعنی 0.3 درصد) دیده شد، از جمله سرطان دیگری در تخمدان، سه مورد استئوسارکوم و دو مورد مزوتلیومای بدخیم و یک مورد از هر سرطان غده تیروئید و سرطان سلولهای بزرگ ریه (شکل 5ب-5هـ). فهرستی از سرطانهای PSA منفی در جدول-3 ارائه شده است.
نمونههایی از رنگ ایمنی PSA در شکل تکمیلی 2 نشان داده شده است. تمام هشت بافت سالم پروستات، دارای PSA مثبت بودند در حالی که رنگ PSA در سایر بافتهای سالم و آنالیزشده از جمله موارد زیر وجود نداشت:بافتهای مزانشیمی {(آئورت/اینتیما، آئورت/مدیا)، قلب (بطن چپ)، عضله اسکلتی، ماهیچه اسکلتی/زبان، میومتر، آپاندیس (دیواره عضلانی)، مری (دیواره عضلانی)، معده (دیواره عضلانی)، ایلئوم (دیواره عضلانی)، روده (دیواره عضلانی)، لگن، کلیه (دیواره عضلانی)، مثانه (دیواره عضلانی)، آلت تناسلی مرد (گلانس/جسم اسفنجی)، تخمدان (استروما)، بافت چربی (سفید)}، سطوح (پوست (سطح)، پوست (موها، غدد چربی)، لب (اپیتلیوم)، حفره دهان، لوزه (اپیتلیوم سطحی)، کانال مقعد (پوست)، کانال مقعد (اپیتلیوم انتقالی)، اگزوسرویکس، مری، لگن، کلیه، مثانه، آمنیون/کوریون، معده (آنتروم)، معده (فندوس و جسم)، روده کوچک، اثنی عشر، روده کوچک، ایلئوم، آپاندیس، کولون نزولی، رکتوم، کیسه صفرا، برونش، سینوس پارانازال) و اندام های جامد (غده لنفاوی، طحال، تیموس، لوزه، کبد، پانکراس، غده پاروتید، غده زیر فکی، غده زیرزبانی، لب (غده بزاقی کوچک)، اثنی عشر (غده برونر)، قشر کلیه، مدولای کلیه، پروستات، وزیکول منی، اپیدیدیم، بیضه، ریه (پارنشیم)، ریه (غدد برونش)، سینه، اندوسرویکس، آندومتر (تکثیر) آندومتر (ترشح)، لوله فالوپ، آندومتر (دسیدوای اولیه)، تخمدان (استروما)، تخمدان (جسم زرد)، تخمدان (کیست فولیکولی)، جفت (سه ماهه اول)، جفت (بالغ)، غده فوق کلیوی، غده پاراتیروئید، تیروئید، مخچه، مخ، غده هیپوفیز (لوب خلفی)، غده هیپوفیز (لوب قدامی)).
حساسیت و مشخصه DIA-PSA در غلظت/ رقت آنتیبادی به میزان 1:100 و 1:800
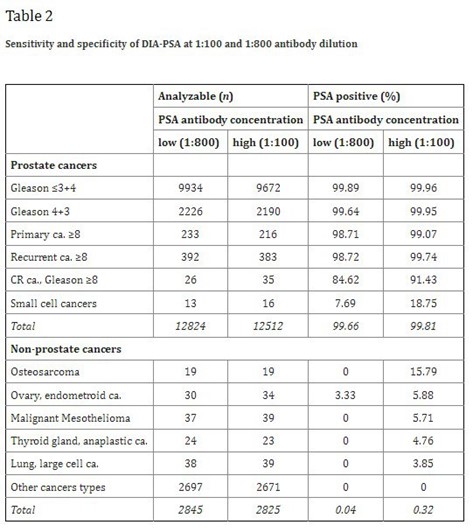
نمونههایی از رنگ ایمنی PSA مثبت در تومورهای غیرپروستات
(الف) غلظت/ رقت آنتیبادی ضد PSA به میزان 1:800
(ب-هـ) غلظت/رقت آنتیبادی به میزان 1:100
رنگ انواع تومور با DIA-PSA منفی است
گفتگو
دادههای این تحقیق نشان میدهد که اندازهگیری PSA ، فارغ از مشخصه و حساسیت بالا و شناختهشده آن درخصوص بافت اپیتلیال پروستات؛ اطلاعات پیشآگاهی قابل توجهی در بیماران مبتلا به سرطان پروستات ارائه میدهد.آنالیز ایمونوهیستوشیمی نمایه پروتئین، تابع محدودیتهای ذاتی است. غلظت رنگ و سیگنال آن به نسبت (درصد) نویز، بهطور قابلتوجهی بستگی به نوع شناساگرها و پروتکلهای تجربی بکارگرفتهشده دارد. بر این اساس، در اکثر پروتئینهایی که توسط گروههای مختلف تحقیقاتی آنالیز شدهاند، دادههای مکتوب مربوط به نمایه ایمونوهیستوشیمی ِشناساییشده، بسیار متغیر است.محدوده نسبتاً کوچکی که در آن، نمایه پروتئین در ایمونوهیستوشیمی روشن، قابل اندازهگیری است، در این مشکل سهیم است. در روش آزمایشی انتخابشده، محدوده نمایهای تعریف میشود که در پایین آن، همه رنگها «منفی» و بالای آن، همه نتایج رنگها، «کاملا مثبت» خواهند بود. اگر نمایه رنگ ایمنی منتهی به عناصر بافتی «قهوهای تیره» شود، دیگر غلظت ده برابری پروتئین مورد نظر، منجر به رنگ غلیظتر نخواهد شد. برای به حداقل رساندن ریسک این که روش آزمایشی به دادههای صرفا خوب یا بد منتهی شود، آنهم فقط به این دلیل که ما در انتخاب پروتکل مناسب خوششانس بودیم (یا نه)، ما بررسی و تحقیق پیشآگاهی سرطان پروستات را با استفاده از دو غلظت مختلف آنتیبادی با ضریب هشت انجام دادیم.به طور کلی این دادهها نشان میدهد که سطح نمایه PSA در سلولهای سرطان پروستات یکی از قویترین ویژگیهای پیشآگاهی برای (اطمینان از) وجود تومور است.
این مساله نه فقط با میزان (ارزش) پیشآگاهی مستقل رنگ PSA در چندین مدل نشان داده میشود، بلکه با اثر شدید پیشآگاهی در سرطانهایی نشان داده میشود که در آنها PTEN حذف شده است. حذف PTEN یکی دیگر از ویژگیهای مهم پیشآگاهی است که اخیراً توسط چندین نویسنده برای اندازهگیری پراکسیس روتین توصیه شده است. در زیرگروه سرطانهایی که در آنها PTEN حذف شده، بیشتر بیومارکرهای پیشآگاهی، اثر پیشآگاهی خود را از دست میدهند در حالی که معمولا چنین مواردی با نمایه ضعیف پیشآگاهی شناخته میشوند. دلیل تهاجم بیشتر تومور در سرطانهایی که در آنها نمایه PSA کم شده، هنوز مشخص نیست. پیشنهاد برخی نویسندگان، نقش محافظتی PSA در تومور بوده است. مثلا «هایدمن و همکاران» نشان دادند که PSA با تبدیل Lys-plasminogen به قطعات شبهآنژیواستاتین فعال بیولوژیکی، از خواص ضدرگزایی بهره میجوید. «گیکا و همکاران» دریافتند که PSA از طریق تحریک یک کانال یونی خاص در غشای پلاسما، تحرک سلولهای سرطانی پروستات PC-3 را کاهش میدهد.
«بیندوکومار و همکاران» گزارش دادند که در موشها، درمان (با) PSA نمایه فاکتورهای رشد را تنظیم و تعدیل میکند و رشد زنوگرافتهای تومور پروستات را سرکوب میکند. با این حال، تولید PSA ممکن است یکی از مهمترین عملکردهای سلولهای سالم غده پروستات باشد. بنابراین میتوان حدس زد که کمبود قابل اندازهگیری در این عملکرد، ممکن است نشانه ظریفی از تمایززدایی سلولی باشد. رنگ PSA در غدههای سالم پروستات در مرز سلول آپیکال بسیار غلیظ است. این که نبود رنگ غالب PSA در این فیزیولوژی آپیکال مستقیماً با نمایه ضعیف پیشآگاهی مرتبط است، صرف نظر از غلظت رنگ قابل رویت، در تطابق با PSA تغییریافته است که «تفاوتزدایی» را نشان میدهد.آنالیز موفق بیش از 12,000 مورد سرطان پروستات نشان داد که حتی در مورد بیماریهای تمایزنیافته یعنی با گلیسون بزرگتر یا مساوی 8 (Gleason ≥8) یا مقاوم به اختگی، در بیش از 99درصد از سرطان های پروستات، نمایه PSA در سطحی دیده میشود که در غلظت بالاتر آنتیبادی قابل تشخیص است. چهارصدم درصد (%0.04) سرطانهای با PSA منفی یعنی با گلیسون کوچکتر یا مساوی با هفت (Gleason≤ 3+4=7) ، به احتمال زیاد به دلیل آسیب بافتی پیشتحلیلی مثلا ناشی از تثبیت ناکافی یا طولانیمدت فرمالین بودهاند.
بر اساس نوشتههای قبلی، انتظار میرفت که سرطانهای سلولهای کوچک عصبی غدد درونریز عمدتاً دارای PSA منفی باشند. با این حال، قابل توجه است که سه مورد از 15کارسینوم سلول کوچک، به طور قابل توجهی PSA را نشان میدهند. این امر نشان میدهد که ایمونوهیستوشیمی PSA ممکن است به شناسایی منشا پروستات در بخشی از کارسینومهای سلول کوچک کمک کند. در آنالیز بیش از 2,800 تومور غیرپروستات معلوم شد که رنگ ایمونوهیستوشیمی PSA مثبت فقطً مختص پروستات نیست. با این حال، به خوبی مشخص شده که ممکن است در سرطانها، انواع پروتئینها بطور نابجا نشان داده شوند.بنابراین تولید نابجای PSA اصلا تعجبآور نیست. در چند تحقیق قبلی، رنگ PSA در بخشهای قابلتوجهی از بافتهای طبیعی و نئوپلاستیک خارج پروستات گزارش شده است. برای مثال نمایه PSA در این موارد دیده شد:در 9-60 درصد از سرطانهای سینه و شش مورد از 11 آدنوم پلئومورفیک غده بزاقی و یک مورد کارسینوم مجرای بزاقی و تمام 56 غده سالم بزاقی و صد درصد از 62 نمونه از پانکراس سالم و غدد سالم بزاقی، آدنوم پلئومورفیک، آدنوکارسینوم و تومور Warthin ، در موارد تکی آدنوکارسینوم پارایورترال و سرطان مثانه و همچنین در 22مورد از 40 مورد (%55) ملانومای بدخیم.طبق بررسی جامع ما بر روی تومورهای غیرپروستات، نمایه PSA شاهدی برای مشکل قابل توجه ایمونوهیستوشیمی PSA بدست نمیدهد.
رنگ ایمونوهیستوشیمی PSA نادر است و معمولاً در تومورهای خارج از پروستات خفیف است. تنها مورد سرطان خارج از پروستات با PSA مثبت در(1:800) ، یک تومور زنانه بود. یک گزارش موردی از سرطان تخمدان اندومتروئید با PSA مثبت نیز در نوشتهها موجود است. این که غلظت/رقت به میزان(1:800) ممکن است سبب افزایش مشخصه تست تشخیصی شود بدون آن که حساسیت قابل توجهی از بین برود، با توجه به ملاحظات اقتصادی نیز ارزشمند است، مسالهای که امروزه در بسیاری از موسسات آزمایشگاهی نگرانی اصلی محسوب میشود.به طور خلاصه، در مقایسه دو پروتکل ایمونوهیستوشیمی، غلظت بالای آنتیبادی به عنوان یک رویکرد تشخیصی مناسب شناسایی میشود که به مشخصه 99/9 درصدی، حساسیت کلی 99/7 درصد و حساسیت در بافتشناسیهای با گلیسون بزرگتر یا مساویی هشت(Gleason ≥8) ، معادل 98.7 درصد منتهی میشود. همچنین در این دادهها، نمایه PSA به عنوان یک پارامتر پیشآگاهی قابل توجه، شناسایی میشود. میزان بالای تاثیر پیشآگاهی در اندازهگیری PSA که با هر دو غلظت مختلف آنتیبادی یکسان است، نشان میدهد که نمایه پیشآگاهی PSA محدوده بسیار گستردهای را دربرمیگیرد. کمیسازی نمایه PSA در محدودهای وسیعتر -برای مثال با استفاده از فلورسانس- ممکن است به اطلاعات پیشآگاهی بهتری منتهی شود.
مواد و روشها
مطالعه پیشآگاهی سرطان پروستات
TMA پیشآگاهی سرطان پروستات شامل یک نمونه از هر 17,747 بیمار بود که بین سالهای 1992 تا 2015در بخش اورولوژی و کلینیکهای مارتینی در مرکز پزشکی دانشگاه هامبورگ-اپندورف تحت عمل جراحی قرار گرفتند. تمام نمونههای پروستات براساس یک روش استاندارد، از جمله جاسازی کامل کل پروستات برای آنالیز بافتشناسی، مورد بررسی و تجزیهوتحلیل قرار گرفتند. دادههای پیگیری برای مجموع 14,667 نفر بیمار با میانگین پیگیری 48ماه (محدوده: 1 تا 276 ماه)، در دسترس قرار داشت. دادههای پاتولوژیک و بالینی بافتی در جدول-4 خلاصه شده است. پایگاه داده مولکولی پیوستشده به این TMA حاوی نتایجی در مورد نمایه ERG، تجزیه ERG جدا از آنالیز FISH و وضعیت حذف 10q23 (PTEN) است. نمایه پروتئین ERG از 5,515 (تومور) و آنالیز بازآرایی ERG با هیبریداسیون درجا فلورسانس (FISH) از 8,134 تومور و وضعیت حذف 10q23 (PTEN) از 5,158 تومور.
ترکیب ریزآرایه بافتی پیشآگاهی پروستات
توجه:
در دستههای مختلف اعداد همیشه جمع نمیشوند تا به 17,747 برسند، چون مواردی با دادههای ناقص وجود دارند.
مخفف:
AJCC، کمیته مشترک آمریکایی در زمینه سرطان
بافت طبیعی، سرطان پیشرفته پروستات و TMA چندتوموری
TMA بافت سالم متشکل از هشت نمونه از هر 76 نوع بافت مختلف و سالم (608 نمونه در یک اسلاید) بود. هر نمونه از اهداکننده متفاوتی استخراج شد. TMA چندتوموری ما شامل 6-50 نمونه (مجموعا: 3,442 نمونه) بود که هر کدام از 82 گروه و زیرگروه مختلف تومور انسانی در میان هشت بلوک مختلف TMA توزیع شده بودند. ترکیب دقیق TMAهای سالم و چندتوموری در بخش نتایج ارائه شده است. برای پردازش سرطانهای پروستات که به احتمال زیاد نمایه PSA پایینی دارند، در یک TMA «سرطان پیشرفته پروستات» اضافی، بافتهایی از 316 بیمار قرار داده شد که به دلیل سرطان مکرر و پیشرفته پروستات، در قسمت مجرای ادراری برش داده شده بودند.
گروه شامل 55 نفر بیمار بود که به اخته شدن مقاوم بودند و 257 بیمار که حساسیت سرطانی آنها به ترک هورمون، ناشناخته بود. در تمام مجموعههای TMA، استوانههای بافتی با قطر 0.6 میلیمتر از تومور معرف یا نواحی طبیعی هر بلوک بافتی، پانچ شده و به بلوک پارافینی گیرنده انتقال داده شدند. تمام نمونههای تومور از بایگانی «موسسه آسیبشناسی مرکز پزشکی دانشگاه هامبورگ اپندورف» بدست آمد. استفاده از بافتهای باقیمانده تشخیصی بایگانیشده برای ساخت TMA و آنالیز آنها برای اهداف تحقیقاتی طبق قوانین محلی (HmbKHG, & 12,1)) و از سوی کمیته محلی مربوط به اخلاق (کمیسیون اخلاق هامبورگ (Ethics commission Hamburg, WF-049/09) تایید شده است. انجام تمام کارها مطابق با اعلامیه هلسینکی (Helsinki Declaration) صورت گرفته است.
ایمونوهیستوشیمی (IHC)
ایمونوهیستوشیمی مقاطع تازه برشدادهشده TMA در یک روز و در یک آزمایش انجام شد. آنتیبادی مونوکلونال PSA موش (Danova DIA-PSA, clone HAM15) در (1:100) و (1:800) اعمال شد. اسلایدها پارافینزدایی شدند و در معرض بازیابی آنتیژن با القای گرما به مدت پانزده دقیقه در دمای 98 درجه سانتیگراد در محلول بازیابی هدف با pH9.0 مطابق (Agilent, Santa Clara, CA, USA) در یک ماژول PT Link پیشدرمان (Agilent) قرار گرفتند و در دستگاه Austainer Link 48 رنگآمیزی شدند. مراحل پروتکل شامل پنج دقیقه بلاکینگ پراکسیداز (Agilent REAL)، 20 دقیقه انکوباسیون آنتیبادی اولیه در دمای اتاق و تجسم آنتیبادی متصل با استفاده از EnVision Flex Kit (Agilent) طبق صلاحدید و نظر سازنده است. رنگآمیزی در نمونههای بافت آنالیزشده معمولاً همگن بود و غلظت رنگآمیزی همه موارد بهصورت نیمهکمی در چهار دسته منفی، ضعیف، متوسط و شدید ارزیابی شد.
قدردانی
سپاسگزاری برای پشتیبانی عالی فنی از:
Ilknur Aynur, Ferdag Guen, Felisa Fürstenberger, Maren Eisenberg, Inge Brandt and Sünje Seekamp.
منابع:
1.Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019; 69:7–34. 10.3322/caac.21551. [PubMed] [CrossRef] [Google Scholar]
2.Malm J, Lilja H. Biochemistry of prostate specific antigen, PSA. Scand J Clin Lab Invest Suppl. 1995; 221:15–22. 10.3109/00365519509090559. [PubMed] [CrossRef] [Google Scholar]
3.Lilja H. A kallikrein-like serine protease in prostatic fluid cleaves the predominant seminal vesicle protein. J Clin Invest. 1985; 76:1899–1903. 10.1172/JCI112185. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
4.Babaian RJ, Troncoso P, Steelhammer LC, Lloreta-Trull J, Ramirez EI. Tumor volume and prostate specific antigen: implications for early detection and defining a window of curability. J Urol. 1995; 154:1808–1812. 10.1016/S0022-5347(01)66790-9. [PubMed] [CrossRef] [Google Scholar]
5.Epstein JI, Egevad L, Humphrey PA, Montironi R. Members of the IIiDUPG. Best practices recommendations in the application of immunohistochemistry in the prostate: report from the International Society of Urologic Pathology consensus conference. Am J Surg Pathol. 2014; 38:e6–e19. 10.1097/PAS.0000000000000238. [PubMed] [CrossRef] [Google Scholar]
6.Goldstein NS. Immunophenotypic characterization of 225 prostate adenocarcinomas with intermediate or high Gleason scores. Am J Clin Pathol. 2002; 117:471–477. 10.1309/G6PR-Y774-X738-FG2K. [PubMed] [CrossRef] [Google Scholar]
7.Abrahamsson PA, Lilja H, Falkmer S, Wadstrom LB. Immunohistochemical distribution of the three predominant secretory proteins in the parenchyma of hyperplastic and neoplastic prostate glands. Prostate. 1988; 12:39–46. 10.1002/pros.2990120106. [PubMed] [CrossRef] [Google Scholar]
8.Gallee MP, Visser-de Jong E, van der Korput JA, van der Kwast TH, ten Kate FJ, Schroeder FH, Trapman J. Variation of prostate-specific antigen expression in different tumour growth patterns present in prostatectomy specimens. Urol Res. 1990; 18:181–187. 10.1007/BF00295844. [PubMed] [CrossRef] [Google Scholar]
9.Varma M, Morgan M, Jasani B, Tamboli P, Amin MB. Polyclonal anti-PSA is more sensitive but less specific than monoclonal anti-PSA: Implications for diagnostic prostatic pathology. Am J Clin Pathol. 2002; 118:202–207. 10.1309/BGWQ-P26T-7TR6-VGT3. [PubMed] [CrossRef] [Google Scholar]
10.Erbersdobler A, Isbarn H, Steiner I, Schlomm T, Chun F, Mirlacher M, Sauter G. Predictive value of prostate-specific antigen expression in prostate cancer: a tissue microarray study. Urology. 2009; 74:1169–1173. 10.1016/j.urology.2009.02.061. [PubMed] [CrossRef] [Google Scholar]
11.Schlomm T, Iwers L, Kirstein P, Jessen B, Kollermann J, Minner S, Passow-Drolet A, Mirlacher M, Milde-Langosch K, Graefen M, Haese A, Steuber T, Simon R, et al.. Clinical significance of p53 alterations in surgically treated prostate cancers. Mod Pathol. 2008; 21:1371–1378. 10.1038/modpathol.2008.104. [PubMed] [CrossRef] [Google Scholar]
12.Weischenfeldt J, Simon R, Feuerbach L, Schlangen K, Weichenhan D, Minner S, Wuttig D, Warnatz HJ, Stehr H, Rausch T, Jager N, Gu L, Bogatyrova O, et al.. Integrative genomic analyses reveal an androgen-driven somatic alteration landscape in early-onset prostate cancer. Cancer Cell. 2013; 23:159–170. 10.1016/j.ccr.2013.01.002. [PubMed] [CrossRef] [Google Scholar]
13.Minner S, Enodien M, Sirma H, Luebke AM, Krohn A, Mayer PS, Simon R, Tennstedt P, Muller J, Scholz L, Brase JC, Liu AY, Schluter H, et al.. ERG status is unrelated to PSA recurrence in radically operated prostate cancer in the absence of antihormonal therapy. Clin Cancer Res. 2011; 17:5878–5888. 10.1158/1078-0432.CCR-11-1251. [PubMed] [CrossRef] [Google Scholar]
14.Minner S, Wittmer C, Graefen M, Salomon G, Steuber T, Haese A, Huland H, Bokemeyer C, Yekebas E, Dierlamm J, Balabanov S, Kilic E, Wilczak W, et al.. High level PSMA expression is associated with early PSA recurrence in surgically treated prostate cancer. Prostate. 2011; 71:281–288. 10.1002/pros.21241. [PubMed] [CrossRef] [Google Scholar]
15.Krohn A, Diedler T, Burkhardt L, Mayer PS, De Silva C, Meyer-Kornblum M, Kotschau D, Tennstedt P, Huang J, Gerhauser C, Mader M, Kurtz S, Sirma H, et al.. Genomic deletion of PTEN is associated with tumor progression and early PSA recurrence in ERG fusion-positive and fusion-negative prostate cancer. Am J Pathol. 2012; 181:401–412. 10.1016/j.ajpath.2012.04.026. [PubMed] [CrossRef] [Google Scholar]
16.Rawnaq T, Quaas A, Zander H, Gros SJ, Reichelt U, Blessmann M, Wilzcak W, Schachner M, Sauter G, Izbicki JR, Kaifi JT. L1 is highly expressed in tumors of the nervous system: a study of over 8000 human tissues. J Surg Res. 2012; 173:314–9. 10.1016/j.jss.2010.10.029. [PubMed] [CrossRef] [Google Scholar]
17.Person F, Wilczak W, Hube-Magg C, Burdelski C, Moller-Koop C, Simon R, Noriega M, Sauter G, Steurer S, Burdak-Rothkamm S, Jacobsen F. Prevalence of βIII-tubulin (TUBB3) expression in human normal tissues and cancers. Tumour Biol. 2017; 39:1010428317712166. 10.1177/1010428317712166. [PubMed] [CrossRef] [Google Scholar]
18.Burdelski C, Jakani-Karimi N, Jacobsen F, Moller-Koop C, Minner S, Simon R, Sauter G, Steurer S, Clauditz TS, Wilczak W. IMP3 overexpression occurs in various important cancer types and is linked to aggressive tumor features: A tissue microarray study on 8,877 human cancers and normal tissues. Oncol Rep. 2018; 39:3–12. 10.3892/or.2017.6072. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
19.Baak JP, Van Diermen B, Steinbakk A, Janssen E, Skaland I, Mutter GL, Fiane B, Lovslett K. Lack of PTEN expression in endometrial intraepithelial neoplasia is correlated with cancer progression. Hum Pathol. 2005; 36:555–561. 10.1016/j.humpath.2005.02.018. [PubMed] [CrossRef] [Google Scholar]
20.Lotan TL, Gurel B, Sutcliffe S, Esopi D, Liu W, Xu J, Hicks JL, Park BH, Humphreys E, Partin AW, Han M, Netto GJ, Isaacs WB, et al.. PTEN protein loss by immunostaining: analytic validation and prognostic indicator for a high risk surgical cohort of prostate cancer patients. Clin Cancer Res. 2011; 17:6563–6573. 10.1158/1078-0432.CCR-11-1244. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21.Sabha N, Knobbe CB, Maganti M, Al Omar S, Bernstein M, Cairns R, Cako B, von Deimling A, Capper D, Mak TW, Kiehl TR, Carvalho P, Garrett E, et al.. Analysis of IDH mutation, 1p/19q deletion, and PTEN loss delineates prognosis in clinical low-grade diffuse gliomas. Neuro Oncol. 2014; 16:914–923. 10.1093/neuonc/not299. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
22.Carvalho KC, Maia BM, Omae SV, Rocha AA, Covizzi LP, Vassallo J, Rocha RM, Soares FA. Best practice for PTEN gene and protein assessment in anatomic pathology. Acta Histochem. 2014; 116:25–31. 10.1016/j.acthis.2013.04.013. [PubMed] [CrossRef] [Google Scholar]
23.Burdelski C, Fitzner M, Hube-Magg C, Kluth M, Heumann A, Simon R, Krech T, Clauditz T, Buscheck F, Steurer S, Wittmer C, Hinsch A, Luebke AM, et al.. Overexpression of the A Disintegrin and Metalloproteinase ADAM15 is linked to a Small but Highly Aggressive Subset of Prostate Cancers. Neoplasia. 2017; 19:279–287. 10.1016/j.neo.2017.01.005. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24.Burdelski C, Menan D, Tsourlakis MC, Kluth M, Hube-Magg C, Melling N, Minner S, Koop C, Graefen M, Heinzer H, Wittmer C, Sauter G, Simon R, et al.. The prognostic value of SUMO1/Sentrin specific peptidase 1 (SENP1) in prostate cancer is limited to ERG-fusion positive tumors lacking PTEN deletion. BMC Cancer. 2015; 15:538. 10.1186/s12885-015-1555-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25.Heidtmann HH, Nettelbeck DM, Mingels A, Jager R, Welker HG, Kontermann RE. Generation of angiostatin-like fragments from plasminogen by prostate-specific antigen. Br J Cancer. 1999; 81:1269–1273. 10.1038/sj.bjc.6692167. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
26.Gkika D, Flourakis M, Lemonnier L, Prevarskaya N. PSA reduces prostate cancer cell motility by stimulating TRPM8 activity and plasma membrane expression. Oncogene. 2010; 29:4611–4616. 10.1038/onc.2010.210. [PubMed] [CrossRef] [Google Scholar]
27.Bindukumar B, Schwartz SA, Nair MP, Aalinkeel R, Kawinski E, Chadha KC. Prostate-specific antigen modulates the expression of genes involved in prostate tumor growth. Neoplasia. 2005; 7:241–252. 10.1593/neo.04529. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
28.Schron DS, Gipson T, Mendelsohn G. The histogenesis of small cell carcinoma of the prostate. An immunohistochemical study. Cancer. 1984; 53:2478–2480. 10.1002/1097-0142(19840601)53:112478::AID-CNCR28205311193.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]
29.Okada H, Gotoh A, Ogawa T, Arakawa S, Ohbayashi C, Kamidono S. Two cases of small cell carcinoma of the prostate. Scand J Urol Nephrol. 1996; 30:503–508. 10.3109/00365599609182334. [PubMed] [CrossRef] [Google Scholar]
30.Yao JL, Madeb R, Bourne P, Lei J, Yang X, Tickoo S, Liu Z, Tan D, Cheng L, Hatem F, Huang J, Anthony di Sant’Agnese P. Small cell carcinoma of the prostate: an immunohistochemical study. Am J Surg Pathol. 2006; 30:705–712. 10.1097/00000478-200606000-00005. [PubMed] [CrossRef] [Google Scholar]
31.Wang W, Epstein JI. Small cell carcinoma of the prostate. A morphologic and immunohistochemical study of 95 cases. Am J Surg Pathol. 2008; 32:65–71. 10.1097/PAS.0b013e318058a96b. [PubMed] [CrossRef] [Google Scholar]
32.Bradner JE, Hnisz D, Young RA. Transcriptional Addiction in Cancer. Cell. 2017; 168:629–643. 10.1016/j.cell.2016.12.013. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
33.Poh BH, Jayaram G, Sthaneshwar P, Yip CH. Prostate-specific antigen in breast disease. Malays J Pathol. 2008; 30:43–51. [PubMed] [Google Scholar]
34.Alanen KA, Kuopio T, Collan YU, Kronqvist P, Juntti L, Nevalainen TJ. Immunohistochemical labelling for prostate-specific antigen in breast carcinomas. Breast Cancer Res Treat. 1999; 56:169–176. 10.1023/A:1006210627219. [PubMed] [CrossRef] [Google Scholar]
35.Heyl W, Wolff JM, Biesterfeld S, Schroder W, Zitzelsberger D, Jakse G, Rath W. Immunohistochemical analysis of prostate-specific antigen does not correlate to other prognostic factors in breast cancer. Anticancer Res. 1999; 19:2563–2565. [PubMed] [Google Scholar]
36.Miller MK, Unger PD, Bleiweiss IJ. Immunohistochemical analysis of prostate specific antigen in breast cancer. Breast Cancer Res Treat. 2001; 68:111–116. 10.1023/A:1011959127928. [PubMed] [CrossRef] [Google Scholar]
37.Ilvan S, Celik V, Cetinaslan I, Calay Z, Ferahman M. Immunohistochemical analysis of prostate-specific antigen in female breast cancer. J BUON. 2004; 9:183–186. [PubMed] [Google Scholar]
38.Narita D, Cimpean AM, Anghel A, Raica M. Prostate-specific antigen value as a marker in breast cancer. Neoplasma. 2006; 53:161–167. [PubMed] [Google Scholar]
39.van Krieken JH. Prostate marker immunoreactivity in salivary gland neoplasms. A rare pitfall in immunohistochemistry. Am J Surg Pathol. 1993; 17:410–414. 10.1097/00000478-199304000-00012. [PubMed] [CrossRef] [Google Scholar]
40.James GK, Pudek M, Berean KW, Diamandis EP, Archibald BL. Salivary duct carcinoma secreting prostate-specific antigen. Am J Clin Pathol. 1996; 106:242–247. 10.1093/ajcp/106.2.242. [PubMed] [CrossRef] [Google Scholar]
41.Tazawa K, Kurihara Y, Kamoshida S, Tsukada K, Tsutsumi Y. Localization of prostate-specific antigen-like immunoreactivity in human salivary gland and salivary gland tumors. Pathol Int. 1999; 49:500–505. 10.1046/j.1440-1827.1999.00900.x. [PubMed] [CrossRef] [Google Scholar]
42.Elgamal AA, Ectors NL, Sunardhi-Widyaputra S, Van Poppel HP, Van Damme BJ, Baert LV. Detection of prostate specific antigen in pancreas and salivary glands: a potential impact on prostate cancer overestimation. J Urol. 1996; 156:464–468. 10.1016/S0022-5347(01)65883-X. [PubMed] [CrossRef] [Google Scholar]
43.Svanholm H, Andersen OP, Rohl H. Tumour of female paraurethral duct. Immunohistochemical similarity with prostatic carcinoma. Virchows Arch A Pathol Anat Histopathol. 1987; 411:395–398. 10.1007/BF00713386. [PubMed] [CrossRef] [Google Scholar]
44.Spencer JR, Brodin AG, Ignatoff JM. Clear cell adenocarcinoma of the urethra: evidence for origin within paraurethral ducts. J Urol. 1990; 143:122–125. 10.1016/S0022-5347(17)39887-7. [PubMed] [CrossRef] [Google Scholar]
45.Zaviacic M, Sidlo J, Borovsky M. Prostate specific antigen and prostate specific acid phosphatase in adenocarcinoma of Skene’s paraurethral glands and ducts. Virchows Arch A Pathol Anat Histopathol. 1993; 423:503–505. 10.1007/BF01606542. [PubMed] [CrossRef] [Google Scholar]
46.Ebisuno S, Miyai M, Nagareda T. Clear cell adenocarcinoma of the female urethra showing positive staining with antibodies to prostate-specific antigen and prostatic acid phosphatase. Urology. 1995; 45:682–685. 10.1016/S0090-4295(99)80066-1. [PubMed] [CrossRef] [Google Scholar]
47.Sloboda J, Zaviacic M, Jakubovsky J, Hammar E, Johnsen J. Metastasizing adenocarcinoma of the female prostate (Skene’s paraurethral glands). Histological and immunohistochemical prostate markers studies and first ultrastructural observation. Pathol Res Pract. 1998; 194:129–136. 10.1016/S0344-0338(98)80080-0. [PubMed] [CrossRef] [Google Scholar]
48.Grignon DJ, Ro JY, Ayala AG, Johnson DE, Ordonez NG. Primary adenocarcinoma of the urinary bladder. A clinicopathologic analysis of 72 cases. Cancer. 1991; 67:2165–2172. 10.1002/1097-0142(19910415)67:82165::AID-CNCR28206708273.0.CO;2-M. [PubMed] [CrossRef] [Google Scholar]
49.Bodey B, Bodey B Jr, Kaiser HE. Immunocytochemical detection of prostate specific antigen expression in human primary and metastatic melanomas. Anticancer Res. 1997; 17:2343–2346. [PubMed] [Google Scholar]
50.Yu H, Diamandis EP, Levesque M, Asa SL, Monne M, Croce CM. Expression of the prostate-specific antigen gene by a primary ovarian carcinoma. Cancer Res. 1995; 55:1603–1606. [PubMed] [Google Scholar]
